- 1. ¿Cuáles son las diferentes fases de la cicatrización normal de una herida?
- 2. ¿Cuáles son los principales factores de retraso en la cicatrización de una herida?
- 3. ¿Qué fármacos influyen en la cicatrización de las heridas?
- 4. ¿Cuál es el efecto de los dermocorticoides en la cicatrización?
- 5. ¿Hay diferencias entre la cicatrización de heridas agudas y crónicas?
- 6. ¿Cómo se deben limpiar las heridas?
- 7. ¿Cuáles son las características de la cicatrización de heridas en niños?
- 8. ¿Cuáles son las características de la cicatrización de heridas en personas mayores?
- 9. ¿Cómo se aborda la cicatrización en pacientes con cáncer?
- 10. ¿Cuáles son las características de la cicatrización en pacientes con quemaduras?
- 11. ¿Qué apósito elegir según el aspecto de la herida?
- 12. ¿Qué lugar ocupan los dermocosméticos en la cicatrización?
- 13. ¿Existen terapias alternativas para la cicatrización?
- 14. ¿Qué consejos hay que dar al paciente para conseguir una cicatriz estética (en posoperatorio y postraumático)?
- 15. ¿Qué es una cicatriz patológica y por qué se desarrolla?
- 16. ¿Cómo abordar las cicatrices patológicas?
- 17. ¿Qué hacer en caso de úlcera de la pierna para lograr su cicatrización?
- 18. ¿Qué hacer en caso de escara para lograr su cicatrización?
- 19. ¿Qué hacer en caso de herida de pie diabético para lograr su cicatrización?
- 20. ¿Qué relación hay entre la cicatrización y la mente?
1. ¿Cuáles son las diferentes fases de la cicatrización normal de una herida?
La cicatrización de una lesión cutánea aguda traumática o quirúrgica implica un proceso complejo y singular. Para comprender las pautas generales de la cicatrización, es más fácil dividir las distintas fases sucesivas, sin olvidar que se solapan en tiempo y espacio (Figura 1) [1, 2]. Por otra parte, es importante entender que estas diferentes etapas fisiológicas se ven alteradas en caso de herida crónica con retraso en la cicatrización.
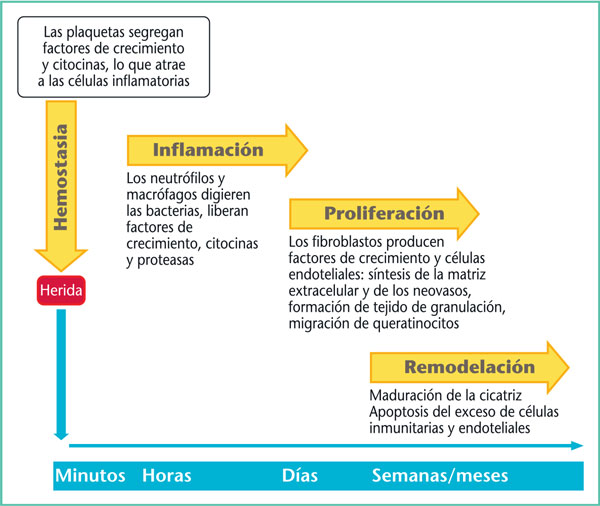
Figura 1. Esquema de la cicatrización fisiológica.
La primerafase después de la formación de la herida es la hemostasia y la formación de una matriz provisional. Esta fase consiste en una sucesión de mecanismos celulares y moleculares que permiten no solo la coagulación para disminuir la hemorragia, sino también la intervención de múltiples citocinas y factores de crecimiento que actuarán en la síntesis de colágeno, la angiogénesis e incluso la reepitelización.
Acontinuación, se produce una fase de inflamación que comienza con una etapa de inflamación primaria, con el reclutamiento de polinucleares neutrófilos, que luego da paso a una etapa de inflamación secundaria, con la transformación de los monocitos en macrófagos. Los neutrófilos desempeñan una función importante en los primeros días, ya que luchan contra la agresión bacteriana, ayudan a la degradación del tejido necrótico y atraen a otras células inflamatorias. Aproximadamente 3 días después de la lesión, los macrófagos se convierten en las células más destacables para la cicatrización, gracias a su capacidad para destruir restos celulares y sintetizar numerosos factores de crecimiento para activarla siguiente fase de proliferación.
La proliferación es la fase en la que se produce la reconstrucción del tejido dañado, la reepitelización y la formación del entramado vascular. Estaetapa crucial tiene lugar en las primeras semanas, y da lugar a la formación del tejido de granulación. La reepitelización se produce gracias a la proliferación de queratinocitos que provienen de los bordes de la lesión y que tienen la capacidad de migrar al interior de la matrizen formación, así como de células madre epidérmicas situadas en la zona de protuberancia de los folículos pilosos (Figura 2). La proliferación fisiológica se consigue mediante un equilibrio entre la degradación y la síntesis de la matriz extracelular. Este equilibrio se descompensa en las cicatrices patológicas, con una mayor degradación en caso de retraso en la cicatrización, o con una mayor síntesis en el caso de las cicatrices queloides e hipertróficas.
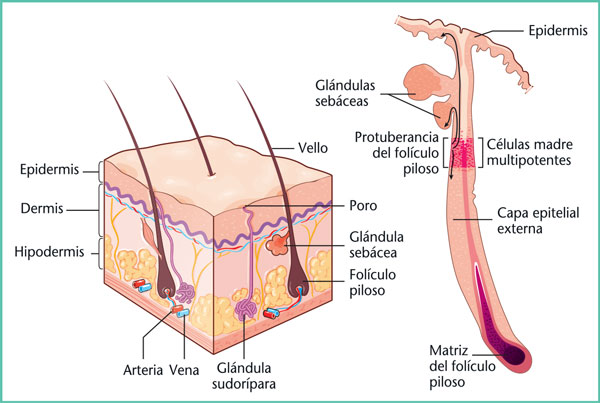
Figura 2. Piel y células madre.
Por último, la fase de maduración consiste en un conjunto de modificaciones de los componentes de la matriz extracelular. Comienza unas tressemanas después de la lesión y puede durar hasta dos años, por lo que el aspecto «definitivo» de una cicatriz sólo puede apreciarse tras este periodo. El colágeno se reordena, orientándose según las fuerzas de tracción, pero no presentará el mismo entrecruzamiento que el de una piel no lesionada. Además, las glándulas sudoríparas y los folículos pilosos no se reconstruyen, por lo que la piel cicatrizada no puede ser idéntica a la piel original. Finalmente, dado que la proliferación de melanocitos se produce en una segunda fase, la cicatriz, al principio, aparece más pálida que el resto del tegumento.
Referencias
1. Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med 1999;341: 738-46.
2. Eming SA, Krieg T, Davidson JM. Inflammation in wound repair: molecular and cellular mechanisms. J Invest Dermatol2007; 127: 514-25.
3. Suivi en ville des plaies chroniques : ulcère veineux de jambe, escarre, plaie du pied diabétique. Assurance maladie, octobre 2015.
4. Plaies aiguës en structure d’urgence. Référentiel de bonnes pratiques. SFMU, 2017: 32 p.
5. Sgonc R, Gruber J. Age-related aspects of cutaneous wound hea- ling: a mini-review. Gerontology 2013; 59: 159-64.
6. Majtan J. Honey: an immunomodulator in wound healing. Wound Repair Regen 2014; 22: 187-92.
7. Opletalová K, BlaizotX, Mourgeon B, et al. Maggot therapyfor wound debridement: a randomized multicenter trial. Arch Dermatol 2012; 148: 432-8.
8. van den Broek LJ, Limandjaja GC, Niessen FB, Gibbs S. Human hypertrophic and keloid scar models: principles, limitations and future challenges from a tissueengineering perspective. ExpDer- matol 2014; 23: 382-6.
9. Prise en charge de l’ulcère de jambe à prédominance veineuse hors pansement. Recommandations HAS, 2006.
10. La compression médicale dans les affections veineuses chroniques. Fiche de bon usage HAS, 2010.
11. Edmonds M, Lázaro-Martínez JL, Alfayate-García JM, et al. Sucrose octasulfate dressing versus control dressing in patients with neu- roischaemic diabetic foot ulcers (Explorer): an international, multi- centre, double-blind, randomised, controlled trial [published correction appears in Lancet Diabetes Endocrinol 2018]. Lancet Diabetes Endocrinol 2018; 6: 186-96.
12. Reinholz M, Poetschke J, Schwaiger H, Epple A, Ruzicka T, Gauglitz GG. The dermatology life quality index as a means to assess life quality in patients with different scar types. J Eur Acad Dermatol Venereol2015; 29: 2112-9.

