- 1. ¿Cuáles son las diferentes fases de la cicatrización normal de una herida?
- 2. ¿Cuáles son los principales factores de retraso en la cicatrización de una herida?
- 3. ¿Qué fármacos influyen en la cicatrización de las heridas?
- 4. ¿Cuál es el efecto de los dermocorticoides en la cicatrización?
- 5. ¿Hay diferencias entre la cicatrización de heridas agudas y crónicas?
- 6. ¿Cómo se deben limpiar las heridas?
- 7. ¿Cuáles son las características de la cicatrización de heridas en niños?
- 8. ¿Cuáles son las características de la cicatrización de heridas en personas mayores?
- 9. ¿Cómo se aborda la cicatrización en pacientes con cáncer?
- 10. ¿Cuáles son las características de la cicatrización en pacientes con quemaduras?
- 11. ¿Qué apósito elegir según el aspecto de la herida?
- 12. ¿Qué lugar ocupan los dermocosméticos en la cicatrización?
- 13. ¿Existen terapias alternativas para la cicatrización?
- 14. ¿Qué consejos hay que dar al paciente para conseguir una cicatriz estética (en posoperatorio y postraumático)?
- 15. ¿Qué es una cicatriz patológica y por qué se desarrolla?
- 16. ¿Cómo abordar las cicatrices patológicas?
- 17. ¿Qué hacer en caso de úlcera de la pierna para lograr su cicatrización?
- 18. ¿Qué hacer en caso de escara para lograr su cicatrización?
- 19. ¿Qué hacer en caso de herida de pie diabético para lograr su cicatrización?
- 20. ¿Qué relación hay entre la cicatrización y la mente?
10. ¿Cuáles son las características de la cicatrización en pacientes con quemaduras?
Se estima que cada año se queman en Francia 400 000 personas(de las que más de un tercio son niños). Por lo tanto,es importante que todos los profesionales sepan hacer una valoración precisa de la herida. Con esta evaluación se puede derivar al paciente a un especialista si es necesario, quien propondrá un abordaje terapéutico para lograr una cicatrización óptima.
La profundidad de las quemaduras corresponde al nivel anatómico alcanzado, y se distingue entre:
• quemaduras superficiales (1er grado y 2o grado superficial): tratamiento médico y cicatrización sin secuelas;
• quemaduras profundas (2o grado profundo y 3er grado): por lo general, el tratamiento requiere la intervención de un cirujano plástico y la cicatrización tiene secuelas (Figura 7 y Tabla 3).
Lo primero que hay que hacer en caso de quemadura es enfriarla bajo el agua del grifo durante un tiempo prolongado (unos diez minutos). El alivio del dolor, en un primer momento, es esencial. También debe evaluarse el estado de vacunación antitetánica del paciente, como en el caso de cualquier herida.
Las quemaduras superficiales se deben tratar con:
• limpieza con agua y jabón;
• escisión de ampollas (excepto en las palmas de las manos y las plantas de los pies);
• vendaje diario con gasa vaselinada.
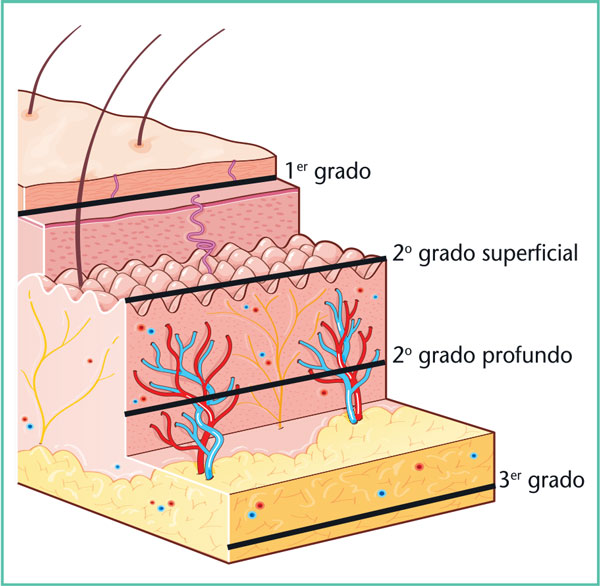
Figura 7. Clasificación de quemaduras por grados.
Tabla 3. Diferencias de aspecto clínico de la quemadura según el grado
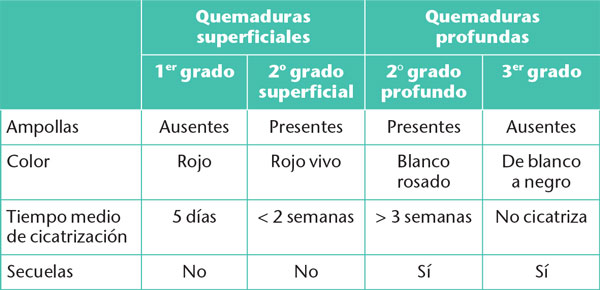
La cicatrización se suele alcanzar en menos de dos semanas, si no es así, el paciente debe acudir a un centro especializado. El retraso en la cicatrización puede deberse a un diagnóstico inicial erróneo, ya que evaluar la profundidad no siempre es sencillo. Esto puede explicar el retraso de cicatrización y, en el caso de las quemaduras de segundo grado, justifica una reevaluación sistemática temprana a las 24-48 horas.
Las quemaduras profundas deben tratarse siempre en una unidad especializada de quemados para examinarlas y hacer un injerto de piel con rapidez.
Referencias
1. Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med 1999;341: 738-46.
2. Eming SA, Krieg T, Davidson JM. Inflammation in wound repair: molecular and cellular mechanisms. J Invest Dermatol2007; 127: 514-25.
3. Suivi en ville des plaies chroniques : ulcère veineux de jambe, escarre, plaie du pied diabétique. Assurance maladie, octobre 2015.
4. Plaies aiguës en structure d’urgence. Référentiel de bonnes pratiques. SFMU, 2017: 32 p.
5. Sgonc R, Gruber J. Age-related aspects of cutaneous wound hea- ling: a mini-review. Gerontology 2013; 59: 159-64.
6. Majtan J. Honey: an immunomodulator in wound healing. Wound Repair Regen 2014; 22: 187-92.
7. Opletalová K, BlaizotX, Mourgeon B, et al. Maggot therapyfor wound debridement: a randomized multicenter trial. Arch Dermatol 2012; 148: 432-8.
8. van den Broek LJ, Limandjaja GC, Niessen FB, Gibbs S. Human hypertrophic and keloid scar models: principles, limitations and future challenges from a tissueengineering perspective. ExpDer- matol 2014; 23: 382-6.
9. Prise en charge de l’ulcère de jambe à prédominance veineuse hors pansement. Recommandations HAS, 2006.
10. La compression médicale dans les affections veineuses chroniques. Fiche de bon usage HAS, 2010.
11. Edmonds M, Lázaro-Martínez JL, Alfayate-García JM, et al. Sucrose octasulfate dressing versus control dressing in patients with neu- roischaemic diabetic foot ulcers (Explorer): an international, multi- centre, double-blind, randomised, controlled trial [published correction appears in Lancet Diabetes Endocrinol 2018]. Lancet Diabetes Endocrinol 2018; 6: 186-96.
12. Reinholz M, Poetschke J, Schwaiger H, Epple A, Ruzicka T, Gauglitz GG. The dermatology life quality index as a means to assess life quality in patients with different scar types. J Eur Acad Dermatol Venereol2015; 29: 2112-9.

