- 1. Quelles sont les différentes phases de la cicatrisation normale d’une plaie ?
- 2. Quels sont les principaux 2 facteurs de retard de cicatrisation d’une plaie ?
- 3. Quels sont les médicaments qui influencent la cicatrisation ?
- 4. Quel est l’impact des dermocorticoïdes sur la cicatrisation ?
- 5. Y a-t-il une différence entre cicatrisation des plaies aiguës et chroniques ?
- 6. Comment faut-il nettoyer les plaies ?
- 7. Quelles sont les particularités de la cicatrisation des plaies chez l’enfant ?
- 8. Quelles sont les particularités de la cicatrisation des plaies chez les sujets âgés ?
- 9. Comment gérer la cicatrisation chez le patient cancéreux ?
- 10. Quelles sont les particularités de la cicatrisation chez les patients brûlés ?
- 11. Quel pansement choisir en fonction de l’aspect de la plaie ?
- 12. Quelle est la place des dermocosmétiques dans la cicatrisation ?
- 13. Y a-t-il une place pour les thérapeutiques alternatives dans la cicatrisation ?
- 14. Quels conseils donner au patient pour obtenir une belle cicatrice (en postopératoire et post-traumatique) ?
- 15. Qu’est-ce qu’une cicatrice pathologique et pourquoi se développe-t-elle ?
- 16. Comment prendre en charge les cicatrices pathologiques ?
- 17. Que faire devant un ulcère de jambe pour obtenir sa cicatrisation ?
- 18. Que faire devant une escarre pour obtenir sa cicatrisation ?
- 19. Que faire devant une plaie du pied chez un patient diabétique pour obtenir sa cicatrisation ?
- 20. Quelles sont les relations entre cicatrisation et psychisme ?
1. Quelles sont les différentes phases de la cicatrisation normale d’une plaie ?
La cicatrisation d’une lésion cutanée aiguë traumatique ou chirurgicale met en jeu un processus complexe et unique. Pour comprendre les grandes lignes de la cicatrisation, il est plus aisé de l’aborder en séparant les différentes phases successives, tout en sachant qu’elles se chevauchent dans le temps et dans l’espace (Figure 1) [1, 2]. Par ailleurs, il est important de comprendre que ces différentes étapes physiologiques sont perturbées en cas de plaie chronique avec retard de cicatrisation.
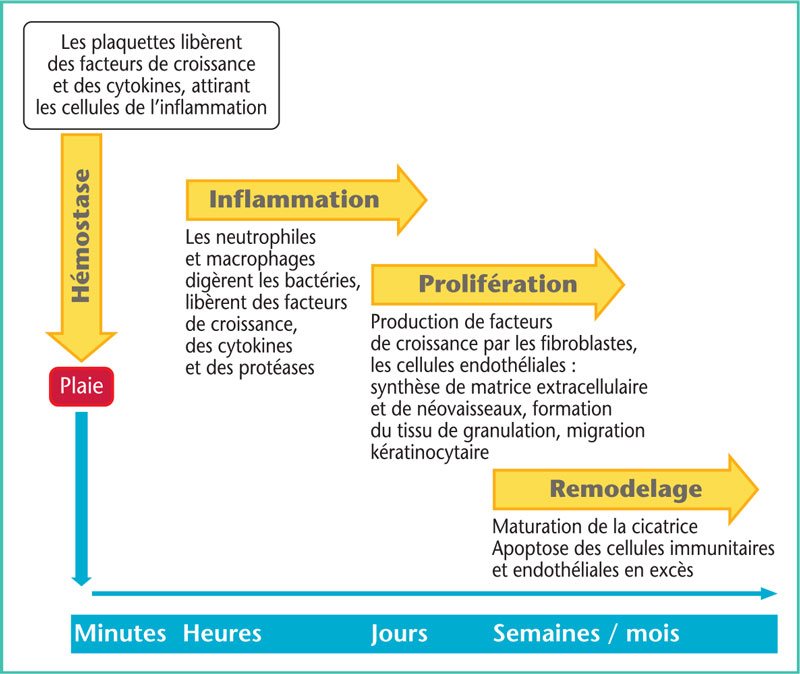
Figure 1. Schéma de cicatrisation physiologique.
La première phase qui fait suite à la formation de la plaie est l’hémostase et la formation d’une matrice provisoire. Cette phase réside en une succession de mécanismes cellulaires et moléculaires qui permettent non seulement la coagulation pour diminuer le saignement, mais aussi l’intervention de multiples cytokines et facteurs de croissances qui agiront dans la synthèse de collagène, l’angiogenèse et même la réépithélialisation.
Il s’ensuit une phase d’inflammation qui débute par une étape d’inflammation primaire, le recrutement des polynucléaires neutrophiles, puis qui laisse place à une étape d’inflammation secondaire, avec la transformation des monocytes en macrophages. Les neutrophiles ont une place majeure dans les premiers jours, car ils luttent contre l’agression bactérienne, aident à la dégradation des tissus nécrosés et attirent d’autres cellules de l’inflammation. Environ 3 jours après la lésion, ce sont les macrophages qui deviennent les cellules primordiales de la cicatrisation, par leurs capacités à détruire les débris cellulaires et à synthétiser de nombreux facteurs de croissance permettant de stimuler la phase suivante de prolifération.
La prolifération est la phase où s’opèrent la reconstruction du tissu lésé, la réépithélialisation et la formation de la trame vasculaire. C’est dans les premières semaines que cette étape cruciale intervient, conduisant à la formation du tissu de granulation. La réépithélialisation se fait à partir de la prolifération de kératinocytes provenant des berges de la lésion, qui ont la capacité de migrer au sein de la matrice en formation, et de cellules souches de l’épiderme localisées dans le « bulge» (zone de renflement) des follicules pileux (Figure 2). La prolifération physiologique se fait grâce à une balance entre dégradation et synthèse de la matrice extracellulaire. Cette balance est déséquilibrée en cas de cicatrices pathologiques : penchant en faveur de la dégradation dans le cas des retards de cicatrisation, et en faveur de la synthèse dans le cas des cicatrices chéloïdes et hypertrophiques.
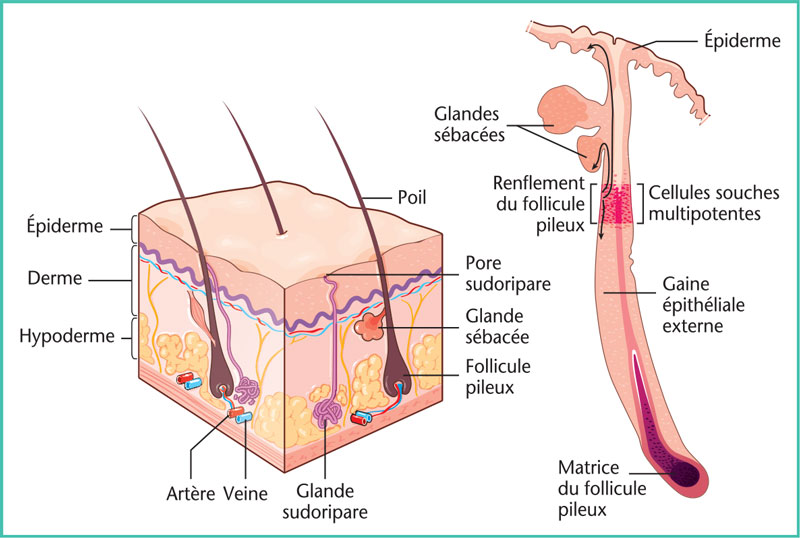
Figure 2. Peau et cellules souches.
Enfin, la phase de maturation détermine un ensemble de modifications des composants de la matrice extracellulaire. Elle débute environ à 3 semaines de la lésion et peut durer jusqu’à 2 ans, raison pour laquellel’aspect « final » d’une cicatrice ne peut être évalué qu’après ce délai. Le collagène se réorganise, s’orientant selon les forces de traction, mais ne présentera pas le même entrelacement que celui d’une peau nonlésée. De plus, les glandes sudoripares et les follicules pileux ne se reconstituent pas, expliquant le fait que la peau cicatrisée ne peut pas être identique à la peau primitive. Enfin, la prolifération mélanocytaire se faisant dans un second temps, la cicatrice apparaît initialement plus pâle que le reste du tégument.
Références
- Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med 1999 ; 341 : 738-46.
- Eming SA, Krieg T, Davidson JM. Inflammation in wound repair: molecular and cellular mechanisms. J Invest Dermatol 2007 ; 127 : 514-25.
- Suivi en ville des plaies chroniques : ulcère veineux de jambe, escarre, plaie du pied diabétique. Assurance maladie, octobre 2015.
- Plaies aiguës en structure d’urgence. Référentiel de bonnes pratiques. SFMU, 2017 : 32 p.
- Sgonc R, Gruber J. Age-related aspects of cutaneous wound hea- ling: a mini-review. Gerontology 2013 ; 59 : 159-64.
- MajtanJ. Honey : an immunomodulator in wound healing.Wound Repair Regen 2014 ; 22 : 187-92.
- Opletalová K, BlaizotX, Mourgeon B, et al. Maggot therapyfor wound debridement: a randomized multicenter trial. Arch Dermatol 2012 ; 148 : 432-8.
- van den Broek LJ, Limandjaja GC, Niessen FB, Gibbs S. Human hypertrophic and keloid scar models: principles, limitations and future challenges from a tissue engineering perspective. Exp Der- matol 2014 ; 23 : 382-6.
- Prise en charge de l’ulcère de jambe à prédominance veineuse hors pansement. Recommandations HAS, 2006.
- La compression médicale dans les affections veineuses chroniques. Fiche de bon usage HAS, 2010.
- Edmonds M, Lázaro-Martínez JL, Alfayate-García JM, et al. Sucrose octasulfate dressing versus control dressing in patients with neu- roischaemic diabetic foot ulcers (Explorer): an international, multi- centre, double-blind, randomised, controlled trial [published correction appears in Lancet Diabetes Endocrinol 2018]. Lancet Diabetes Endocrinol 2018 ; 6 : 186-96.
- Reinholz M, Poetschke J, Schwaiger H, Epple A, Ruzicka T, Gauglitz GG. The dermatology life quality index as a means to assess life quality in patientswith different scar types. J Eur Acad Dermatol Venereol2015 ; 29 : 2112-9.

