- Introduction
- Lymphocytes de type 1, type 2 et type 17
- Immunité et inflammation de type 1, type 2, type 17
- Cytokines, récepteurs des cytokines et voies de signalisation intracellulaire
- Physiopathologie de l’inflammation cutanée
- Phase de résolution de l’inflammation
- Chronicité, rechutes et sévérité des dermatoses inflammatoires chroniques
- Introduction
- Facteurs pathogéniques de la maladie
- Présence d’altérations de la peau non lésionnelle
- Pertes des mélanocytes épidermiques
- Intervention de l’immunité innée
- Intervention de l’immunité adaptative de type 1
- Voies de signalisation impliquées dans le vitiligo
- Intervention de réponses immunitaires autres que celle du type 1
Physiopathologie de l’inflammation cutanée
Le développement d’une dermatose inflammatoire chronique nécessite deux phases : une phase de sensibilisation (phase afférente) et une phase d’expression de l’inflammation (phase efférente).
>| Phase de sensibilisation
La phase de sensibilisation (phase afférente) est cliniquement muette et survient chez un individu jusqu’alors sans lésion cutanée. Les principales données proviennent des modèles expérimentaux. La sensibilisation aboutit à la production de LT CD4+ (Th) et CD8+ (Tc) spécifiques. Pendant cette phase, qui peut durer des années, le patient se sensibilise à des antigènes présents dans la peau : soit des auto-antigènes (vitiligo, pelade) des cellules épidermiques ou d’autres constituants cutanés, soit des antigènes exogènes présentés par des cellules épidermiques (protéines de l’environnement dans la dermatite atopique, haptène dans l’eczéma de contact).
La phase de sensibilisation se déroule dans les organes lymphoïdes (ganglions), seul site où l’activation des LT0 naïfs précurseurs est possible. Parmi les cellules présentatrices d’antigènes, les cellules dendritiques cutanées, qui ont internalisé l’antigène, sont indispensables à cette activation, puisque ce sont les seules cellules présentatrices d’antigènes de la peau capables de migration. La présentation d’haptènes ou d’antigènes par les cellules dendritiques aux LT0 naïfs ganglionnaires aboutit à l’activation optimale de LT effecteurs et mémoires. C’est à ce niveau que survient la polarisation des LT en type 1, type 2 ou type 17, qui dépend du type d’antigène et de l’environnement cytokinique au moment de cette présentation (Figure 1). Les LT spécifiques produits quittent les ganglions et passent dans la circulation sanguine. Commence alors un phénomène de recirculation pendant laquelle les LT migrent du sang vers la peau, quittent la peau par les canaux lymphatiques afférents, séjournent un certain temps dans le ganglion, puis rejoignent la circulation sanguine parle canal thoracique. Si les LT reconnaissent leur antigène lors de leur passage cutané, il s’ensuit une activation lymphocytaire qui est le début de la lésion inflammatoire.
À l’inverse, si les LT ne sont pas activés lors de leur passage dans la peau, ils poursuivent leur programme de recirculation entre le sang, la peau et les organes lymphoïdes. Cette recirculation peut durer des années pour des LT mémoires, jusqu’à ce qu’ils rencontrent éventuellement leur cible.
>| Phase d’expression de l’inflammation cutanée
La phase d’expression de l’inflammation (phase effectrice) survient chez un individu sensibilisé. Chez l’homme, les principales données proviennent des études sur l’eczéma allergique de contact que nous prenons ici comme exemple d’hypersensibilité retardée de type 1 cytotoxique. L’inflammation est induite par l’activation des LT spécifiques et des ILC cutanés (Figure 5). Les LT mémoires présents dans le derme et l’épiderme sont activés par la présentation de l’antigène par les cellules présentatrices cutanées : cellules deLangerhans parl’intermédiaire des molécules du CMHde classe I ou II ; kératinocytes, mélanocytes par l’intermédiaire des molécules du CMH de classe I. En parallèle, les ILC sont activés parles cytokines épidermiques. Les LT et les ILC produisent des cytokines de type 1et des chimiokines qui vont assurer le recrutement des cellules inflammatoires. Ces cytokines et chimiokines vont pouvoir jouer différents rôles selon les maladies et les sous-populations lymphocytaires concernées (cytotoxiques ou activateurs de leur prolifération), mais participeront dans tous les cas à l’activation des cellules endothéliales des capillaires dermiques, avec pour conséquence l’expression de molécules d’adhérence et une vasodilatation qui ralentit le flux sanguin. Les leucocytes circulants peuvent alors interagir avec les cellules endothéliales par l’intermédiaire de molécules d’adhérence, ce qui provoque l’extravasation des cellules inflammatoires dans le derme. Le recrutement de ces différents effecteurs (éventuellement non spécifiques d’antigènes, comme les polynucléaires neutrophiles, éosinophiles, les monocytes,les cellules NK, etc.) conduit à l’amplification de l’inflammation cutanée qui devient visible histologiquement et cliniquement.
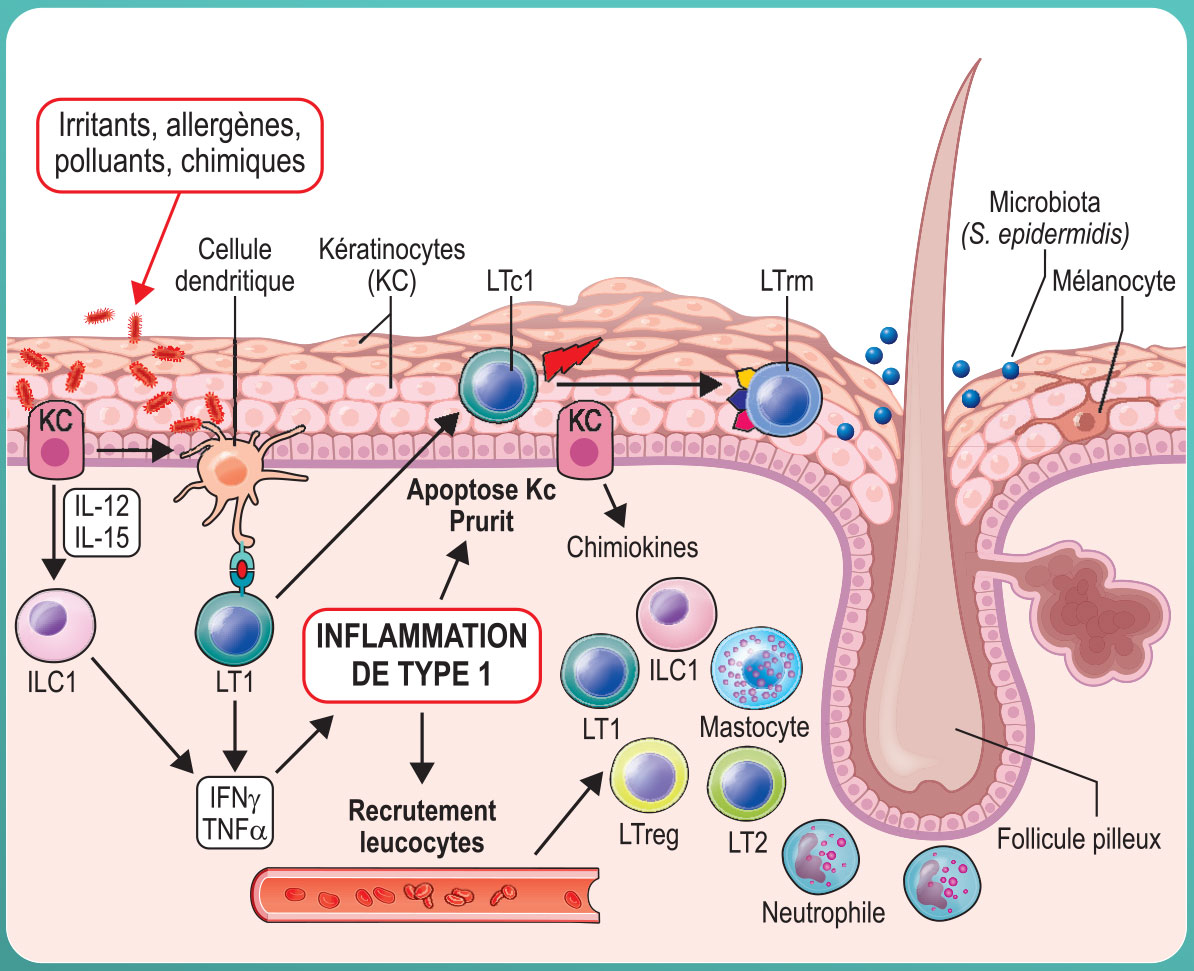
Figure 5. Rôle de l’inflammation de type 1 (cytokines et cytotoxicité) dans l’eczéma allergique de contact. Chez un individu sensibilisé, le contact cutané avec un allergène chimique (haptène) aux propriétés pro-inflammatoires induit l’activation des kératinocytes et la production de cytokines aboutissant à une réponse inflammatoire épithéliale et à l’activation des lymphocytes de type 1. Les LT spécifiques sont activés par la présentation de l’allergène par les cellules cutanées (cellules dendritiques et kératinocytes). Les LT CD8+ induisent l’apoptose des kératinocytes qui leur présentent l’allergène, ce qui aboutit à la spongiose de l’épiderme qui est la caractéristique histologique des eczémas. Les ILC sont activés directement par les cytokines IL-12 et IL-15 produites par les kératinocytes. Les cytokines de type 1 produites par les LT et les ILC vont activer l’ensemble des cellules cutanées qui vont produire une deuxième vague de cytokines/chimiokines aboutissant au recrutement de leucocytes au sein desquels les lymphocytes et les polynucléaires neutrophiles sont majoritaires. Une fois l’inflammation résolue, les LT résidents mémoires (LTrm) persistent dans l’épiderme. Ils pourront être réactivés plus facilement lors des contacts ultérieurs avec l’allergène.
Ainsi, lors de la phase effectrice et quelle que soit la maladie, les cellules T spécifiques de l’antigène (et à l’origine des lésions) seront initialement majoritaires dans la peau, puis seront rapidement « diluées » dans un infiltrat secondaire souvent hétérogène et peu spécifique de la maladie. Ceci explique que l’on préfère réaliser la biopsie d’une lésion cutanée récente plutôt qu’ancienne dans une pathologie inflammatoire difficile à diagnostiquer.

